Abb. 1: Aufbau der Synovialmembran in vivo.
Alexandra Damerau & Dr. Timo Gaber,
Charité,
Berlin
03/2022 – 02/2024
Entzündlich-degenerative Gelenkerkrankungen sind die führende Ursache für Schmerzen und Funktionsstörungen des Bewegungsapparates. Insbesondere fortgeschrittene Stadien sind mit Bewegungseinschränkungen sowie chronischen Schmerzen und damit einhergehenden psychischen Belastungen der Patienten und ökonomischen Belastungen der Gesellschaft verbunden. Die rheumatoide Arthritis (RA) ist eine chronisch-entzündliche Autoimmunerkrankung der Gelenke und wird durch drei unterschiedliche Pathomechanismen unterhalten: einer (i) autoimmunologisch bedingten sterilen Synovitis, (ii) Gelenkdestruktion aufgrund einer tumorartigen Proliferation von Synovialgewebe (Pannusbildung) und (iii) extra-artikulärer Destruktion. Die inflammatorische Synovialmembran konnte hierbei als Schlüsselkomponente ausgemacht werden.
Zur Abbildung der Pathogenese werden in der präklinischen Forschung meist Mäuse und Ratten als Goldstandard eingesetzt. Alternativmethoden im Bereich der Arthritis-Forschung, die es ermöglichen, komplexe Zusammenhänge der Synovialmembran abzubilden, sind derzeit noch rar. So sind bisher vor allem simplifizierte 2D-Modelle beschrieben, die nicht die natürliche physiologische Gewebsarchitektur repräsentieren. Daher werden zunehmend 3D-Modelle entwickelt, die jedoch auf der Verwendung von Zelllinien und tierischen Matrizes basieren.
Ziel des Projektes ist es, ein xeno-freies, human-basiertes in vitro 3D-Synovialmembranmodell zur Simulation der Pathomechanismen der Synovitis und der synovialen Proliferation (Pannusbildung) zu entwickeln. Das Modell soll die physiologische Umgebung - extrazelluläre Matrix (z.B. Kollagen 1), Zellpopulation (Typ A und B Synoviozyten) und -formation (lining und sublining Layer) - widerspiegeln. Grundvoraussetzung ist die vergleichende Charakterisierung mesenchymaler Stromazellen (MSCs) mit synovialen Fibroblasten von Trauma-Patienten (‚gesund‘), da MSCs häufig als fibroblastoide Vorläuferzellen zur in vitro Modellierung verwendet werden.
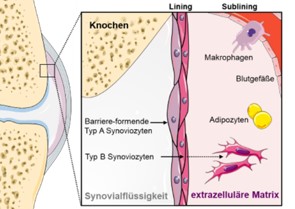
Abb. 1: Aufbau der Synovialmembran in vivo.
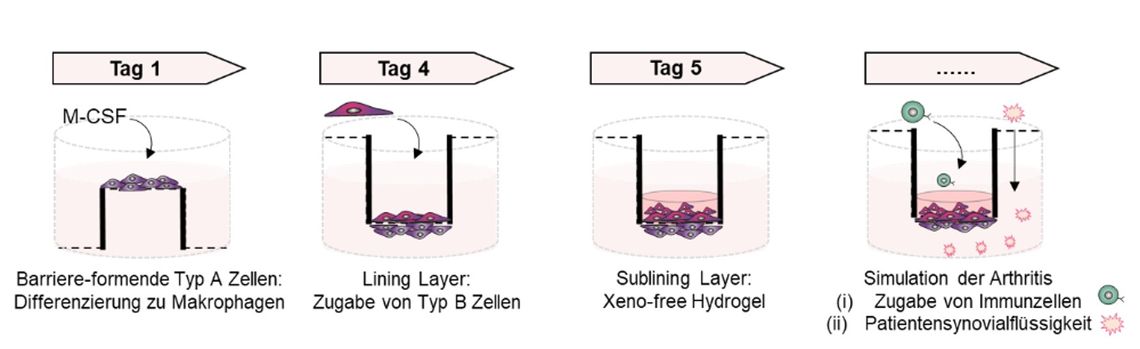
Abb. 2: Aufbau des in vitro 3D-Synovialmembranmodells.
Perspektivisch bietet solch ein validiertes in vitro Synovialmembranmodell eine Alternative zum Tiermodell in der Grundlagenforschung und der angewandten biomedizinischen Forschung, um (i) pathophysiologische Prozesse zu studieren, (ii) potenzielle Zielmoleküle zu identifizieren und (iii) neue therapeutische Strategien sowie Biologika zu testen und schließlich (iv) Tierversuche zu reduzieren.
Charité-Universitätsmedizin Berlin
Medizinische Klinik mit Schwerpunkt Rheumatologie und Klinische Immunologie
Charitéplatz 1
10117 Berlin
03/2022 – 02/2024