Eingeatmete Partikel oder Fasern können akute Entzündungen, in machen Fälle auch verzögert auftretende Erkrankungen wie Lungenfibrose oder auch -krebs hervorrufen. Daher müssen arbeitsmedizinisch relevante Partikel bzw. Stäube, die auf Grund ihrer geringen Größe von weniger als 5 Mikrometern in die tiefen Bereiche der Lungen vordringen können, toxikologisch bewertet werden. Dies geschieht routinemäßig mittels inhalationstoxikologischer Prüfungen, für die es entsprechende OECD-Richtlinien gibt. Jährlich werden ca. 50.000 Ratten für solche Tests eingesetzt. Durch die Einführung der REACH-Gesetzgebung und die Einbeziehung von Nanopartikeln bzw. Nanomaterialien ist jedoch zu erwarten, dass die Anzahl der in Europa benötigten Versuchstiere in den nächsten Jahren weiter zunehmen wird.
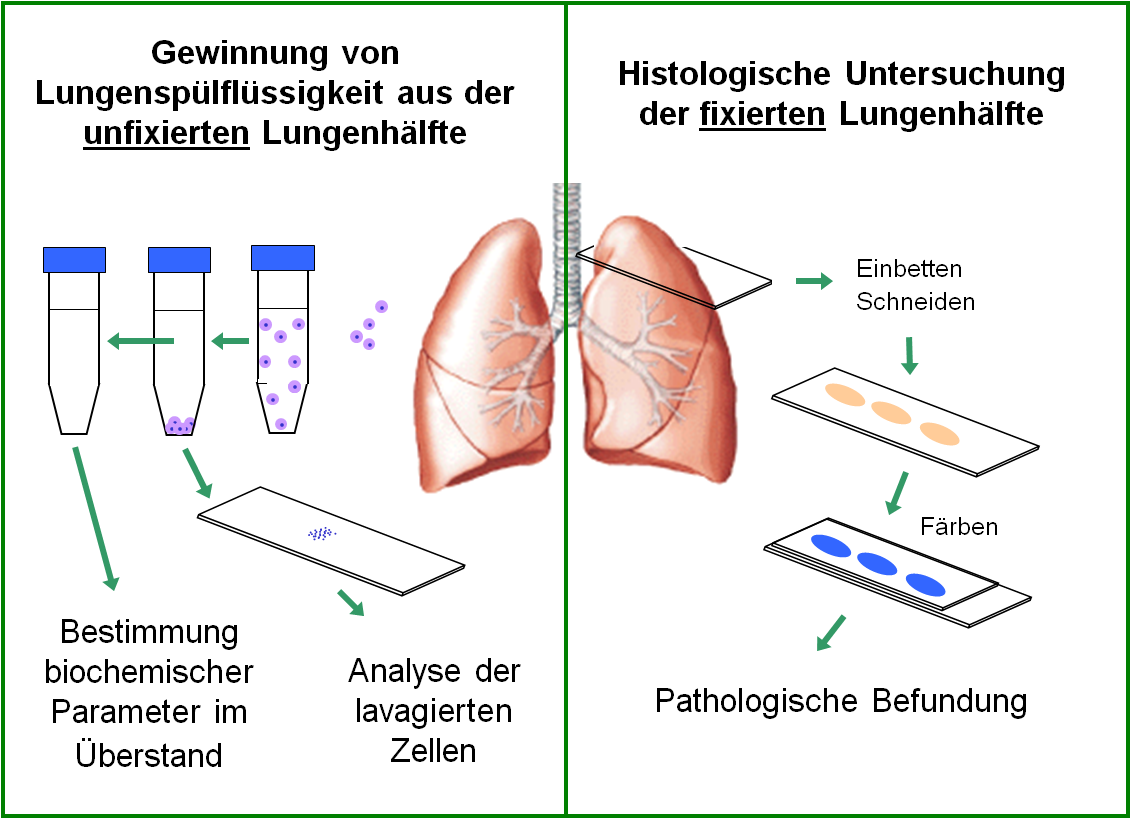
Bei den Tests wird die Atemluft der Versuchstiere (Ratten) mit einer bestimmten Partikelmasse angereichert (meist < 50 mg/m3). Um zu gewährleisten, dass die Partikel nur über die Atemwege aufgenommen werden ist es erforderlich, die Ratten in Röhren zu platzieren, so dass nur die Schnauze der Tiere in die partikelhaltige Atemluft ragt. Diese Exposition wird täglich für sechs Stunden standardisiert durchgeführt und je nach Studiendesign über einige Wochen ausgedehnt. Um die Effekte der Partikel auf die Lunge zu prüfen, wird sowohl die broncho-alveoläre Lungenspülflüssigkeit (BALF) als auch die Gewebestruktur der Lunge zu verschiedenen Zeiten nach Ende der Exposition benötigt. Die in die Lunge eingewanderten Entzündungszellen, Proteine (Enzyme, Zytokine) der BALF sowie mögliche Veränderungen des Lungengewebes werden ausgewertet. Die Abbildungen 1 und 2 verdeutlichen das Prozedere und zeigen typische Befunde. Wichtig ist, dass erst die Zusammenschau aller Untersuchungsergebnisse belastbare Aussagen zur Wirkung der Partikel auf die Lunge liefert. Für die Untersuchungen werden zwei parallel exponierte Tierkollektive eingesetzt, an denen histologische und BALF-Untersuchungen getrennt vorgenommen werden.
Das Forschungsvorhaben hatte zum Ziel, diese Untersuchungen in Zukunft an nur noch einem Tierkollektiv durchzuführen: Dazu soll die rechte Lungenseite zur Gewinnung der BALF, die linke Lungenseite zur Herstellung histologischer Präparate genutzt werden. Die dafür notwendige Hybrid-Präparation wurde bislang in der toxikologischen Laborroutine nicht eingesetzt, da sie zu aufwändig war. Darüber hinaus mangelte es an systematisch erhobenen Daten, die den Vergleich zwischen der konventionellen und der Hybrid-Präparation ermöglicht hätten. /p>
Im Projekt sollte die Vorgehensweise optimiert und in bestehende Protokolle implementiert werden. Dies geschah in Kooperation mit dem anerkannten Testlabor der BASF-SE. Ferner sollte der Vergleich zwischen konventioneller und Hybrid-Präparation durchgeführt werden. Sollte sich die neue Methodik zur Beurteilung der Partikelwirkung als hinreichend erweisen, sollte sie den verantwortlichen Stellen der OECD vorgestellt werden mit dem Ziel, die Methode in eine entsprechend angepasste Richtlinie einfließen zu lassen.
Die Hybrid-Präparationstechnik besitzt einen starken Bezug zum 3R-Konzept. Zwar ist sie im engeren Sinn keine Ersatzmethode (Replacement), mit der das komplexe Geschehen in der Lunge in vitro beurteilt werden könnte, doch erscheint sie geeignet, die Zahl der für Inhalationsexperimente benötigten Tiere zu halbieren (Reduction), was vor dem Hintergrund ansteigender Versuchszahlen dringend geboten erscheint. Hinzu kommt, dass die Hybrid-Präparation erstmals komplette Datensätze für jedes untersuchte Tier liefert. Dadurch wird die Beurteilung individueller Unterschiede erleichtert und die Aussagekraft der Befunde insgesamt gesteigert (Refinemen
Abb. 1: Bei Anwendung der Hybrid-Präparation wird nur aus der rechten Lungenhälfte Lungenspülflüssigkeit gewonnen. Die linke Lungenhälfte wird fixiert und histologisch untersucht. Bei der zuvor gängigen Vorgehensweise wurden diese Untersuchungen noch an zwei verschiedenen Tierkollektiven jeweils an der ganzen Lunge durchgeführt.
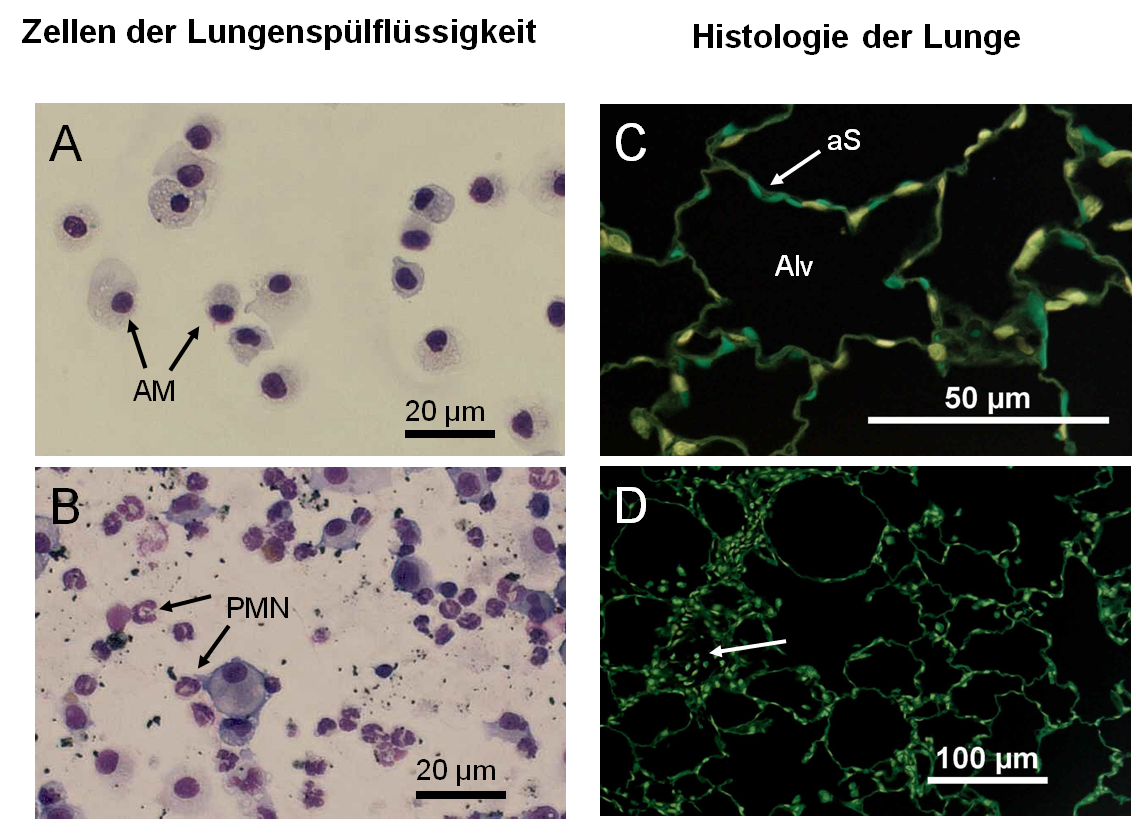
Abb. 2: Typische Befunde einer Untersuchung von Lungenspülflüssigkeit (A, B) und Gewebestruktur (C, D). In der gesunden Lunge (A) finden sich nahezu ausschließlich alveoläre Makrophagen (AM). Eine Partikelbelastung (B) kann einen Entzündungsprozess in Gang setzen, der neutrophile Granulozyten (PMN) ins Lungenparenchym einwandern lässt.Das histologische Erscheinungsbild der gesunden Lunge (C) ist durch die luftgefüllten Alveolen (Alv) gekennzeichnet, die von den feinen Alveolarsepten (aS) gebildet werden. In Partikel-belasteten Lungen (D) finden sich z.B. vermehrt Zellen in den Alveolen (Pfeil). Zudem können Wachstumsprozesse zur Verdickung der Alveolarsepten und vermindertem Gasaustausch führen. (A, B) May-Grünwald-Giemsa-Färbung, (C, D) Paraffinschnitte, HE-Färbung, digital invertiert.
Ergebnisse:
Das Versuchsvorhaben konnte erfolgreich abgeschlossen werden. Dabei gelang es, die Lungen der Versuchstiere (Ratten) im Unterschied zum herkömmlichen Verfahren so aufzuarbeiten, dass Untersuchungen der Lungenspülflüssigkeit und des Gewebes am selben Tier nahezu ohne Einschränkungen möglich sind. Im Sinne des 3R-Prinzips ermöglicht die Methode daher eine Halbierung der Versuchstierzahlen (Reduction) bei gleichzeitiger Verbesserung der Datenlage zur Beurteilung individueller Schwankungen (Refinement).
Für den Erfolg der Untersuchungen waren verschiedene Versuchsansätze notwendig. Im ersten Versuch wurde die rechte Lungenhälfte von gesunden und entzündeten Lungen (nach Gabe von Quarz-Partikeln) einer manuellen Lavage unterzogen. Bei dieser Technik wird das Lungengewebe nicht nur wiederholt mit physiologischer Kochsalzlösung gespült, sondern auch sanft massiert. Auf diese Weise wird eine größere Anzahl von Immunzellen ausgewaschen und kann für verschiedene Untersuchungen eingesetzt werden. Es konnte belegt werden, dass die einseitige manuelle Lavage gegenüber der zweiseitigen keine Nachteile hat und die Diagnostik der Quarz-induzierten Entzündung mit Hilfe der Lungenspülflüssigkeit nicht einschränkte. Weitere Experimente, die in Zusammenarbeit mit dem tierpathologischen Labor der BASF durchgeführt wurden, bestätigten diese quantitativen Ergebnisse und konnten zeigen, dass die nicht-lavagierte linke Lungenhälfte auch für die Routinepathologie sehr gut geeignet ist. Zusätzlich zur ursprünglichen Planung wurden auch die lavagierten rechten Lungen histologisch untersucht. Der überraschende Befund war, dass auch dieses Gewebe trotz der manuellen Lavage keine erkennbaren Veränderungen aufwies. Dieses Ergebnis ist sehr bedeutsam, denn die rechte Lunge besteht aus vier sog. Lungenlappen, von denen jeder einzelne nun weiterhin histologisch auswertbar bleibt, auch wenn die Lunge zuvor lavagiert wurde. Kleine oder lokal begrenzte Gewebeveränderungen, wie z.B. beginnende Tumorbildung, können so zuverlässig entdeckt werden. Anfängliche Befürchtungen, dass Auffälligkeiten in der Lunge mit dem neuen Verfahren übersehen werden, erscheinen daher unbegründet./p>
Als direkte Folge dieses Projektes wurde im Oktober 2017 die OECD-Testguideline 413 überarbeitet, so dass das Hybridverfahren zur Standardmethode für die Langzeituntersuchung toxischer Effekte durch die Inhalation von Nanopartikeln bestimmt wurde.
Ausführende Institution
IBE R&D gGmbH Institute for Lung Health Mendelstr. 11, D-48149 Münster
Projektpartner
Dr. Robert Landsiedel
BASF Product Safety - Experimental Toxicology and Ecology
BASF-SE, GV/TB - Z470, 67056 Ludwigshafen
Förderlaufzeit
06/2013 - 12/2013

 Deutsch
Deutsch