Abb1: iPSC-abgeleitete Podozyten, welche entweder auf Matrigel (A) oder auf verschiedenen Matrigel-freien Beschichtungen wachsen (B-D).
PD Dr. Anja Wilmes,
Vrije Universiteit Amsterdam,
01/2020-12/2021
Humane Zellkultursysteme, insbesondere solche mit humanen pluripotenten Stammzellen (iPSC), sind ein großer Hoffnungsträger in der Entwicklung von relevanteren, Tierversuchs-freien Testsystemen. So können diese z.B. in der Toxikologie gezielt genutzt werden, um die Wirkungsmechanismen von Medikamenten oder Giftstoffen zu bestimmen. iPCS können aus adulten Zellen, z.B. Blutzellen, hergestellt und theoretisch in alle Zellen unseres Körpers differenziert werden. In unserem Labor haben wir z.B. iPSC in verschieden Zellen der Niere (u.a. Podozyten) differenziert, um Substanzen auf Nierentoxizität zu prüfen.
Allerdings ist für die Kultivierung von iPSC eine Beschichtung mit einer spezifischen, extrazellulären Matrix notwendig, ohne die die Zellen im Labor nicht anwachsen können. Hierzu wird überwiegend die Substanz „Matrigel“ verwendet. Für die Gewinnung von Matrigel müssen Mäuse mit Sarkoma-Tumoren induziert werden. Das Gewicht des Tumors beträgt dabei bis zu 20% des gesamten Körpergewichtes der Maus, bevor diese letztendlich geopfert wird.
Matrigel ist momentan eine der meistverwendeten Beschichtungen für iPS-Zellkulturen. Ein Ersatz wäre aus verschiedenen Gründen erstrebenswert, u. a. um bessere Standarisierungen zu erzielen und natürlich aus ethischen Gründen. Obwohl bereits einige alternative Produkte kommerziell verfügbar sind, werden diese nur sehr spärlich in der Forschung eingesetzt. Das liegt u.a. an höheren Kosten sowie an nur eingeschränkt vorhandenen unabhängigen Studien, die die Produkte der verschiedenen Anbieter systematisch vergleichen.
Mit diesem Projekt wollten wir eine gründliche Evaluierung der vorhandenen Produkte mit dem Fokus auf iPSC-Qualität und -Stabilität vornehmen: iPSC müssen ihre Pluripotenz beibehalten und dürfen keine genetischen Veränderungen aufzeigen. Des Weiteren arbeiteten wir an der Entwicklung einer kostengünstigen, neuen Alternative, nämlich der Herstellung von Beschichtungen durch humane Zelllinien.
Ein drittes Ziel des Projektes war es, diese verschiedenen Beschichtungen für das Differenzieren von iPSC in Nierenzellen (z.B. Podozyten) zu testen, so dass auch hier Differenzierungsmethoden entwickelt werden können, die unabhängig von Matrigel sind. Hier lag der Fokus auf der Evaluierung von Podozyten-typischen Markern, wie z.B. Synaptopdin und WT1.
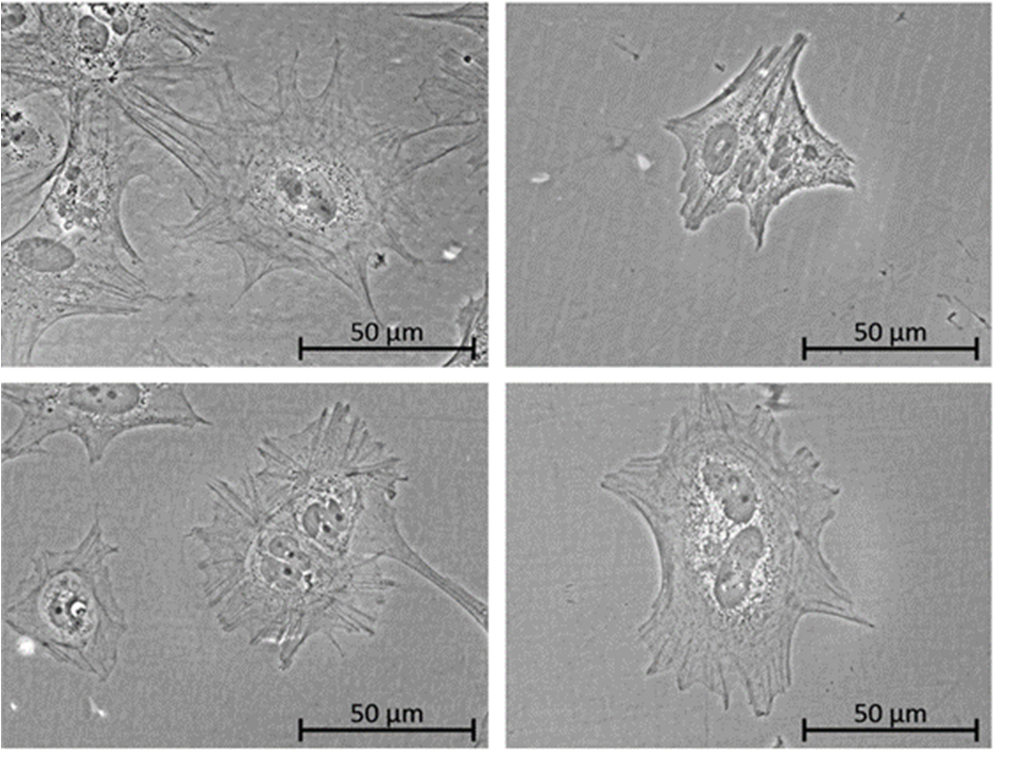
Abb1: iPSC-abgeleitete Podozyten, welche entweder auf Matrigel (A) oder auf verschiedenen Matrigel-freien Beschichtungen wachsen (B-D).
Das Projekt wurde erfolgreich abgeschlossen. Es konnte gezeigt werden, dass das Kultivieren von iPS-Zellen auf den humanen rekombinanten Protein-Beschichtungen Vitronectin, Laminin-511 und Laminin-521 sowie auf der extrazellulären Matrix-Beschichtung, welche von humanen Fibroblasten hergestellt wurde, sehr gut funktioniert. Undifferenzierte iPS-Zellen (von 3 verschiedenen Spendern) exprimierten ähnliche Pluripotenzmarker wie Zellen, welche auf dem in Tieren hergestellten Matrigel kultiviert wurden. Außerdem waren die Karyotyp-Stabilität und das Differenzierungspotential in die 3 Keimblätter auf allen getesteten Beschichtungen vergleichbar.
Die erfolgreiche Differenzierung in Podozyten-artige Zellen von drei verschiedenen Spendern konnte mit den oben genannten Beschichtungen ebenfalls gezeigt werden, sie waren vergleichbar mit Differenzierungen auf Matrigel. Zusätzlichen wurde auch die Differenzierung in renale proximale Tubular-ähnliche Zellen getestet. Hier konnten die besten Ergebnisse mit Beschichtungen aus extrazellulärer Matrix gezeigt werden, welche aus humanen Fibroblasten oder humanen Nierenzellen (RPTEC/TERT1) hergestellt wurden. Diese funktionierten ebenso gut wie Matrigel. Die rekombinanten Proteine Vitronectin und Laminin-511 waren in diesem Fall nicht überzeugend.
Insgesamt konnten wir zeigen, dass Matrigel nicht notwendig ist, um iPS-Zellen zu kultivieren oder diese in renale Podozyten oder proximalen Tubularzellen zu differenzieren und dass es alternative Beschichtungen gibt, welche nun im Detail beurteilt wurden.
Publikationen:
Murphy, C., Naderlinger, E., Mater, A., Kluin, R. J. C. and Wilmes, A. (2023) “Comparison of human recombinant protein coatings and fibroblast-ECM to Matrigel for induced pluripotent stem cell culture and renal podocyte differentiation”, ALTEX - Alternatives to animal experimentation, 40(1), pp. 141–159. doi: 10.14573/altex.2112204.
Chandrasekaran, V., Carta, G., da Costa Pereira, D. et al. (2021). “Generation and characterization of iPSC-derived renal proximal tubule-like cells with extended stability”. Scientific Reports 11, 11575. doi.org/10.1038/s41598-021-89550-4.
Division of Molecular and Computational Toxicology
Vrije Universiteit Amsterdam
De Boelelaan, 1108
1081 HZ Amsterdam, Niederlande
01/2020 - 12/2021