Abb. 1: Übersicht über die im Rahmen des Projektes durchgeführten Untersuchungen zur Erfassung von Nierentoxizität in larvalen Zebrabärblingen.
Prof. Dr. Angela Mally & Dr. Daniel Liedtke,
Universität Würzburg,
06/2018-05/2021
Die Niere ist eines der wichtigsten Zielorgane für toxische Wirkungen von Fremdstoffen. Zahlreiche strukturell unterschiedliche Arzneistoffe, Naturstoffe und Chemikalien können an der Niere zu toxischen Schädigungen führen. Bislang werden nephrotoxische Wirkungen von Arzneimitteln und Chemikalien vor allem im Rahmen gesetzlich vorgeschriebener Toxizitätsprüfungen am Tier erfasst. Mit dem Ziel einer effizienteren Prüfung auf Toxizität und Vermeidung von Tierversuchen vollzieht sich derzeit jedoch ein Paradigmenwechsel in der toxikologischen Prüfung und Risikobewertung weg von apikalen Endpunkten für Toxizität im Tier hin zu In-vitro-Hochdurchsatzverfahren in alternativen Testsystemen. Während sich zellbasierte In-vitro-Assays vor allem durch ihre Hochdurchsatzfähigkeit auszeichnen, können sie die komplexen Vorgänge im Organismus nur unzureichend widerspiegeln und erlauben daher alleine keine hinreichend verlässlichen Aussagen über mögliche Gesundheitsrisiken von Arzneimitteln und Chemikalien. Embryonen des Zebrabärblings (Danio rerio) werden nach den Regelungen des Tierschutzgesetzes bis zum fünften Tag nach der Befruchtung nicht als Tierversuch, sondern als in vitro Tests eingestuft. Daher eignen sie sich in besonderer Weise als Alternativmodell für Toxizitätsscreening, da sie zum einen leicht zugänglich, kostengünstig und für den Einsatz im Hochdurchsatzverfahren geeignet sind und zum anderen die physiologischen Gegebenheiten im Gesamttier, insbesondere hinsichtlich Kinetik und Biotransformation, besser widerspiegeln als zellbasierte Assays.
Die Pronephros genannte Niere im embryonalen Zebrabärbling weist eine sehr einfache Struktur auf und besteht aus lediglich zwei Nephronen. Trotzdem entsprechen der anatomische Aufbau (Glomerulus, proximaler Tubulus, distaler Tubulus, Sammelrohr) und die Funktion weitgehend der menschlichen Niere. Auch Zelltypen, Differenzierungswege und molekulare Signalwege sind zwischen der Niere des Zebrabärblings und der des Menschen bzw. höherer Vertebraten konserviert. Die glomeruläre Filtration setzt innerhalb von 48h nach Fertilisation ein. Damit erfüllen Embryonen des Zebrabärblings grundsätzlich entscheidende Anforderungen an ein alternatives Modell zur Prüfung auf Nephrotoxizität.
Um die Eignung von Tests an Zebrabärblingen für die Vorhersage von Nephrotoxizität zu prüfen, wurden im Projekt erstmals gut charakterisierte Modell-Nephrotoxine auf ihre nierenschädigende Wirkung im larvalen Zebrabärbling untersucht. Als Modell-Nephrotoxine wurden Aristolochiasäure, Cadmiumchlorid, Ochratoxin A, Kaliumbromat und Gentamicin gewählt. Die nierenschädigende Wirkung dieser Substanzen basiert auf unterschiedlichen Primärmechanismen, ist im Säugermodell umfassend charakterisiert und dient somit als Referenz für Untersuchungen am Modell des larvalen Zebrabärblings. Im Gegensatz zu bisher veröffentlichten Studien zur Entwicklungstoxizität erfolgte die 48-stündige Exposition der Larven erst mit Ende der Organogenese ab Tag 3 bis Tag 5 nach Fertilisation. Die im Rahmen des Projektes erbrachten Untersuchungen (Abbildung 1) zur Wirkung der Modell-Nephrotoxine auf den Pronephros des Zebrabärblings zeigten für 4 von 5 der untersuchten Toxine adverse Effekte, welche mit den für diese Substanzen beschriebenen nephrotoxischen Effekten im Säugermodell im Einklang stehen.
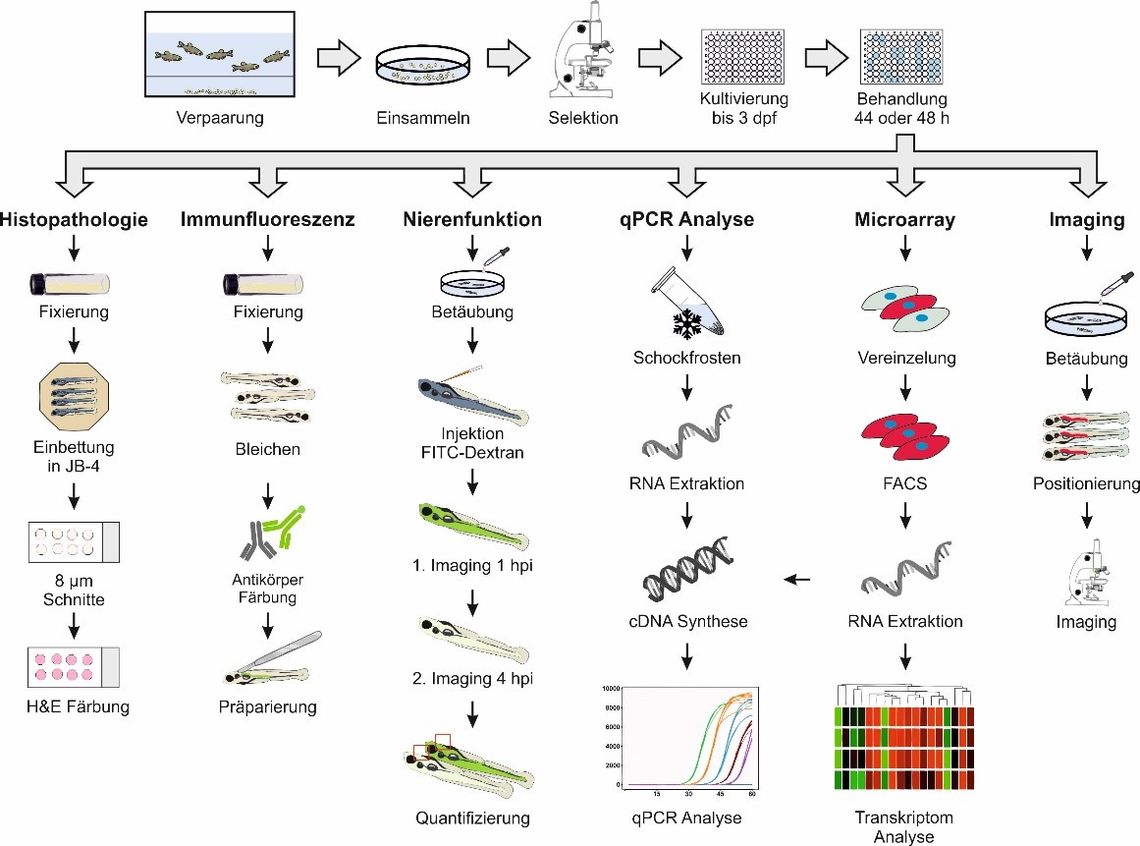
Abb. 1: Übersicht über die im Rahmen des Projektes durchgeführten Untersuchungen zur Erfassung von Nierentoxizität in larvalen Zebrabärblingen.
So konnten nach Substanz-Exposition deutliche histopathologische Veränderungen im proximalen Tubulus der larvalen Niere, Störungen des Expressionsmusters der Pronephros-spezifischen Natrium-Kalium-ATPase α6F, sowie durch Reduktion der renalen Clearance gekennzeichnete Beeinträchtigungen der Nierenfunktion beobachtet werden. Diese Ergebnisse lassen darauf schließen, dass Larven des Zebrabärblings in der Lage sind, die Wirkung nephrotoxischer Substanzen hinsichtlich Art und Lokalisation analog zum Säugermodell abzubilden. Diese Beobachtungen wurden durch substanzbedingte Änderungen der Expression molekularer Biomarker für Nephrotoxizität komplementiert. In aus exponierten Larven isolierten Nierenzellen konnte eine veränderte Expression der Markergene Hämoxygenase 1 (hmox1), Connective Tissue Growth Factor (ctgf), Kidney Injury Molecule 1 (kim-1) und Clusterin (clu) gezeigt werden. Untersuchungen an einer transparenten cdh17:mCherry-Reporterfischlinie zeigen darüber hinaus den Nutzen von cdh17 zur Visualisierung von Läsionen des Pronephros larvaler Zebrabärblinge.
In Anbetracht der vielen Vorteile, welche das larvale Zebrabärbling-Modell mit sich bringt (geringe Haltungskosten, geringer Platzanspruch, optische Transparenz, Hochdurchsatzfähigkeit), offenbaren die hier dargestellten Ergebnisse ein großes Potential zur Detektion nephrotoxischer Wirkungen. Insbesondere die transparente cdh17:mCherry-Reporterfischlinie stellt, integriert in entsprechende Imaging-Pipelines, einen vielversprechenden Ansatz zur Etablierung eines Hochdurchsatz-fähigen Assays zur Detektion nephrotoxischer Stoffe dar, welcher den Entscheidungsfindungs-Prozess beim Hit-to-Lead Screening neuer Substanzen beschleunigen und die Anzahl von Tierversuchen zu reduzieren könnte. Für die Extrapolation der untersuchten Konzentrationen auf den Menschen als Grundlage für die Ableitung sicherer Dosisbereiche für regulatorische Fragstellungen ist weiterhin ein Verständnis der Toxikokinetik der Testsubstanzen in Larven des Zebrabärblings nötig.
Publikationen:
Bauer, B., Liedtke, D., Jarzina, S., Stammler, E., Kreisel, K., Lalomia, V., Diefenbacher, M., Klopocki, E., Mally, A., 2021. Exploration of zebrafish larvae as an alternative whole-animal model for nephrotoxicity testing. Toxicol Lett 344, 69-81.
Bauer, B., Stammler, E., Liedtke, D., Mally, A. Characterization of site-specific nephrotoxicity in embryonic zebrafish. Naunyn-Schmiedeberg's Arch Pharmacol (2019) 39 (Suppl1): S80
Bauer, B., Liedtke, D., Stammler, E., Kreisel, K., Lalomia, V., Kruse, M., Diefenbacher, M., Klopocki, E., Mally, A. Evaluation of larval zebrafish as an alternative whole-animal model for nephrotoxicity testing. EUROTOX Congress 2021
Bachelorarbeit Viola Lalomia, 2020: „Untersuchen der Nephrotoxizität in Larven des Zebrabärblings durch Genexpressionsanalyse“
Bachelorarbeit Marlien Kruse, 2020: „Untersuchungen zur potenziellen Hochdurchsatzfähigkeit transgener embryonaler Zebrabärblinge zur Testung auf Nephrotoxizität“
Arbeitsgruppe Prof. Dr. Angela Mally:
Institut für Pharmakologie und Toxikologie
Universität Würzburg
Versbacher Straße 9, 97078 Würzburg
Dr. Daniel Liedtke:
Institut für Humangenetik
Biozentrum
Universität Würzburg
97074 Würzburg
06/2018 - 02/2021