Abb. 1: Aufbau des Tumormodells.
Neuroblastomzellen (IMR-32) werden von Nierenzellen umgeben. Anfänglich werden hierfür HEK293 bzw. HEK293-GFP-Zellen genutzt, in späteren Versuchen auch primäre Nierenfibroblasten.
Prof. Dr. Jens Kurreck,
TU Berlin
10/2021-09/2023
Gerade im Bereich der Krebsforschung ist die Übertragbarkeit von Ergebnissen aus Tierversuchen auf den Menschen besonders schlecht. Rund 97% der onkologischen Wirkstoffkandidaten, die sich in präklinischen Studien im Tiermodell bewährt haben, scheitern dann in klinischen Studien am Menschen. Eine wichtige Ursache für die geringe Erfolgschance sind die Spezies-spezifischen Unterschiede zwischen Tieren und Menschen. Gleichzeitig sind In-vivo-Versuche in der Krebsforschung besonders belastend für die Tiere.
In diesem Projekt sollen daher humane Tumormodelle durch Biodruck erzeugt werden. Hierbei wird ein Tumor in eine Tumor-Mikroumgebung eingebettet, die aus gesunden menschlichen Zellen besteht (Abb. 1).

Abb. 1: Aufbau des Tumormodells.
Neuroblastomzellen (IMR-32) werden von Nierenzellen umgeben. Anfänglich werden hierfür HEK293 bzw. HEK293-GFP-Zellen genutzt, in späteren Versuchen auch primäre Nierenfibroblasten.
Dadurch können die sehr wichtigen Interaktionen zwischen dem Tumor und den ihn umgebenden Zellen untersucht werden. Exemplarisch soll ein Tumor aus Neuroblastomzellen gedruckt werden, der von Nierenzellen umgeben ist. Die Niere stellt einen - wenn auch selten, aber doch gelegentlich vorkommenden - Ort für Metastasen von Neuroblastomen dar.
In einem weiteren Schritt wird das Tumormodell mit verschiedenen Substanzen behandelt. In Vorversuchen konnten wir bereits zeigen, dass das Krebsmedikament Panobinostat selektiv die Krebszellen durch Induktion der Apoptose abtötet, während die gesunden Zellen der Tumorumgebung unbehelligt bleiben (Abb. 2).
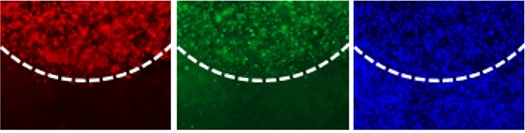
Abb. 2: Fluoreszenzmikroskopische Analyse des Tumormodells nach Behandlung mit einem Krebsmedikament (Panobinostat).
Die rote Fluoreszenz stammt von einem Marker (GD2) für die Neuroblastomzellen. Diese Zellen gehen nach Behandlung mit Panobinostat in den programmierten Zelltod (Apoptose). Der Apoptose-Marker „Cleaved Caspase-3“ ist grün angefäbt. Die blaue Färbung der Zellkerne zeigt die Verteilung sämtlicher Zellen an.
Um die natürliche Physiologie von Geweben nachzubilden, ist es wichtig, die In-vitro-Organmodelle zu vaskularisieren und mit einem Medienstrom zu perfundieren. Hier bietet der Biodruck die Möglichkeit, Kanalstrukturen, die die natürlichen Blutgefäße repräsentieren, in die 3D-Konstrukte zu integrieren. Im Rahmen des Projektes ist es gelungen, einen Kanal in ein Modell für einen Lungentumor zu implementieren. Dieser wurde an einen Medienstrom angeschlossen (Abb. 3). Dadurch war die Viabilität der Zellen erhöht, und ein getestetes Krebsmedikament wirkte unter diesen dynamischen Bedingungen besser als bei statischer Kultivierung.
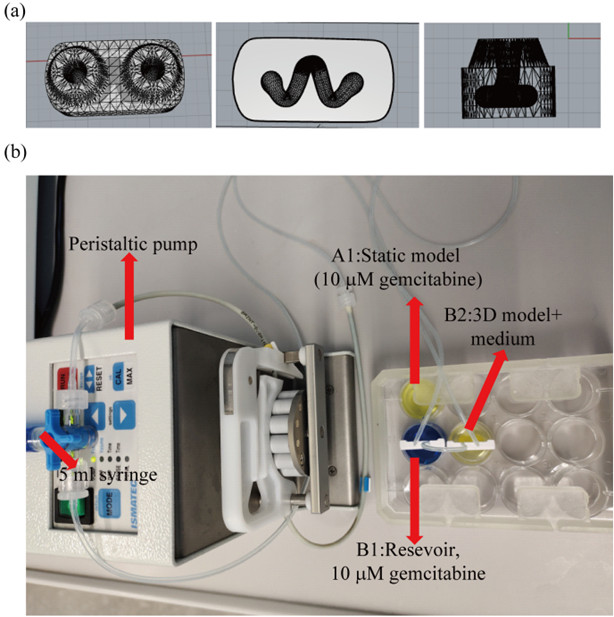
Abb. 3:
Design des gedruckten Lungentumormodells, das von einem Kanal durchzogen wird (a). Das Organmodell wurde an eine peristaltische Pumpe angeschlossen, um es mit einem Medienstrom zu durchspülen (b).
In einer weiterentwickelten Version des Krebsmodells besteht dieses aus einem Tumorkern, der sich in einer Umgebung aus gesunden Zellen befindet. An diesem Modell lassen sich sowohl die Effizienz neuer Krebsmedikamente also auch deren Nebenwirkungen auf umliegendes Gewebe studieren.
Publikationen:
Wu, D.; Berg, J.; Arlt, B.; Röhrs, V.; Al-Zeer, M.A.; Deubzer, H.E.; Kurreck, J. Bioprinted Cancer Model of Neuroblastoma in a Renal Microenvironment as an Efficiently Applicable Drug Testing Platform. Int. J. Mol. Sci. 2022, 23, 122. https:// doi.org/10.3390/ijms23010122
Mei, Y.; Wu, D.; Berg, J.; Tolksdorf, B.; Roehrs, V.; Kurreck, A.; Hiller, T.; Kurreck, J., Generation of a Perfusable 3D Lung Cancer Model by Digital Light Processing. Int. J. Mol. Sci. 2023, 24, 6071.
Wu, D.; Pang, S.; Berg, J.; Mei, Y., Ali, A.S.M.; Röhrs, V.; Tolksdorf, B.; Hagenbuchner, J.; Ausserlechner, M. J.; Deubzer, H.E.; Gurlo, A.; Kurreck, J. Bioprinting of perfusable vascularized organ models for drug development via sacrificial-free direct ink writing. (Submitted)
Prof. Dr. Jens Kurreck
Technische Universität Berlin
Institut für Biotechnologie, Fachgebiet Angewandte Biochemie, TIB 4/3-2
Gustav-Meyer-Allee 25
13355 Berlin
10/2021 - 09/2023