Abb. 1:
Schematische Darstellung des weiterentwickelten Modells zum Transfer von bakteriellen Biofilmen auf humane Lungenepithelzellen. Die Biofilme sollen dabei im Gegensatz zum alten Modell auf die Zellen gedruckt werden.
Prof. Dr. Claus-Michael Lehr,
Helmholtz-Institut für Pharmazeutische Forschung,
Saarbrücken
07/2021 - 01/2024
Zur Bekämpfung von Lungeninfektionen erforscht die Wissenschaft Krankheitsverläufe und entwickelt neue Anti-Infektiva und therapeutische Ansätze. Biofilm-bildende Bakterien stellen dabei eine große medizinische Herausforderung dar. Solche Bakterien können sich besonders bei Risikogruppen, wie z.B. Menschen mit Mukoviszidose, im krankheitsbedingt viskoseren Mukus in der Lunge ansiedeln und dort Biofilme bilden.
Für diese Art der Forschung gelten Tiere trotz bekannter Nachteile immer noch als Standardmodell. In der Regel werden die Versuchstiere (Ratten, Mäusen, Katzen, Meerschweinchen, Schweine, Affen) über die intratracheale oder intranasale Route mit Bakterien-beladenen Agar-Beads infiziert. Solche Tiermodelle werden jedoch nicht nur ethisch, sondern auch wissenschaftlich in Frage gestellt.
Fortschrittliche und der pathophysiologischen Situation in vivo besser angenäherte In-vitro-Modelle könnten somit nicht nur einen Ersatz, sondern sogar eine bessere Alternative bieten, um relevante vorklinische Daten zur Wirksamkeit neuer Anti-Infektiva zu erhalten. Ein Problem besteht jedoch darin, dass Biofilme nicht direkt auf humanen Zellen gezüchtet werden können, da die Zellen durch das rapide Bakterienwachstum rasant absterben würden. Ein anderer Ansatz besteht darin, die Biofilme vorab zu bilden, anschließend abzuschaben und auf die Zellen zu übertragen oder zu pipettieren. Hierbei kann der Biofilm jedoch weder definiert noch reproduzierbar auf die Zellen überführt werden.
In diesem Projekt soll deshalb die 3D-Bioprinting-Technologie genutzt werden, um bakterielle Biofilme in einem Hydrogel reproduzierbar und modellierbar auf humane Epithelzellen aus modernen In-vitro-Systemen zu drucken (Abb. 1). Anschließend soll das Modell als Plattform zur Untersuchung neuer Anti-Infektiva verwendet werden.
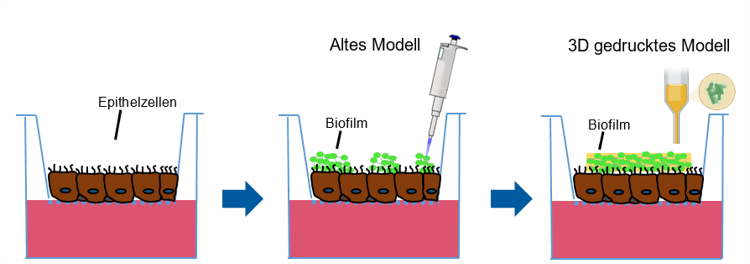
Abb. 1:
Schematische Darstellung des weiterentwickelten Modells zum Transfer von bakteriellen Biofilmen auf humane Lungenepithelzellen. Die Biofilme sollen dabei im Gegensatz zum alten Modell auf die Zellen gedruckt werden.
Dafür wird das Bakterium Pseudomonas aeruginosa (z.B. PA14) zunächst in einem druckbaren Hydrogel gezüchtet, um Material für Biofilme zu bilden. Die Biofilme sollen dann in dem Hydrogel auf humane Lungenepithelzellen definiert und reproduzierbar gedruckt werden. Anschließend soll das Modell charakterisiert werden. Dabei interessieren unter anderem die Viabilität und Barriereeigenschaften der Zellen sowie die Ausschüttung von Zytokinen. Die Anwendbarkeit einer Behandlung mit geeigneten Anti-Infektiva (z.B. Tobramycin, Colistin oder QS-Inhibitoren) und neuartigen (Nano-) formulierungen soll demonstriert werden, indem die Wirksamkeit bei veränderten Barriereeigenschaften und Zytokinausschüttungen beobachtet wird.
Arbeitsgruppe Prof. Dr. Claus-Michael Lehr
"Drug Delivery Across Biological Barriers"
Helmholtz-Institut für Pharmazeutische Forschung Saarland.
Campus E8 1, 66123 Saarbrücken
07/2021 - 01/2024