Hintergrund:
Botulinumtoxin ist ein bakterielles Exotoxin. Es wird vom anaerob wachsenden Sporen-bildenden Bakterium Clostridium Botulinum produziert und gehört zu den potentesten bakteriellen Giften überhaupt. Die tödliche Dosis beim Menschen liegt bei etwa 1 ng/kg Körpergewicht. Botulinumtoxin ist ein Neurotoxin, das die Freisetzung von Überträgersubstanzen aus den Endigungen der Nerven hemmt, die die Muskelkontraktion stimulieren. Dadurch führt es zur schlaffen Lähmung der betroffenen Muskeln. Der Tod tritt durch Lähmung der Atemmuskulatur ein.
Botulinumtoxin ist ein Protein, das aus zwei Untereinheiten besteht. Die große Untereinheit bindet an Nervenzellen und sorgt dafür, dass die kleine Untereinheit in Nervenzellen eindringen kann. In den Nervenzellen zerstört die kleine Untereinheit Proteine, die für die Freisetzung der Überträgersubstanzen aus den Nervenzellen notwendig sind. Es gibt unterschiedliche Serotypen von Botulinumtoxin, die sich sowohl bezüglich der Strukturen, über die das Toxin an Nervenzellen bindet als auch bezüglich der Proteine, die durch die kleine Untereinheit gespalten werden, unterscheiden.
Die Bakterien gedeihen in unzureichend sterilisierten, unter Luftabschluss gelagerten Lebensmitteln, z. B. unsachgemäß zubereiteten Konserven, deren Verzehr zum oft tödlich verlaufenden Krankheitsbild des Botulismus führt. In niedriger Dosierung lokal verabreicht kann Botulinumtoxin aber als Medikament eingesetzt werden, um Krankheitsbilder zu behandeln, die durch eine Dauerkontraktion (Spasmus) eines Muskels oder einer Muskelgruppe zustande kommen wie z. B. den Liedkrampf oder den spastischen Schiefhals. Die breiteste therapeutische Anwendung findet Botulinumtoxin aber in der kosmetischen Medizin, in der es eingesetzt wird, um die Bildung von Hautfältchen durch gezielte Lähmung der die Fältchen verursachenden Hautmuskulatur zu unterdrücken. Dazu wird es in geringer Konzentration in die entsprechenden Hautregionen injiziert.
Botulinumtoxin für die therapeutische Anwendung wird aus Kulturen von Clostridien gewonnen. Bei den dafür notwendigen Reinigungsschritten wird ein Teil des Proteins inaktiviert. Daher besteht das fertige Präparat aus schwankenden Anteilen funktionstüchtigen und inaktiven Proteins. Wegen der hohen Toxizität muss die Aktivität jeder Präparation genau bestimmt werden. Dabei muss die Aktivität sowohl der großen als auch der kleinen Untereinheit erfasst werden. Dies gelingt derzeit am zuverlässigsten durch die Messung der biologischen Wirkung im Ganztier. Dazu wird die Konzentration des Präparates bestimmt, bei der die Hälfte der behandelten Mäuse an Atemlähmung verstirbt. Für diesen Test sterben jährlich weltweit ca. als 300.000 Mäuse einen qualvollen Erstickungstod (http://altweb.jhsph.edu/sebin/c/g/altex_2_10_bitz.pdf; accessed 14. 6. 2012).
Projekt:
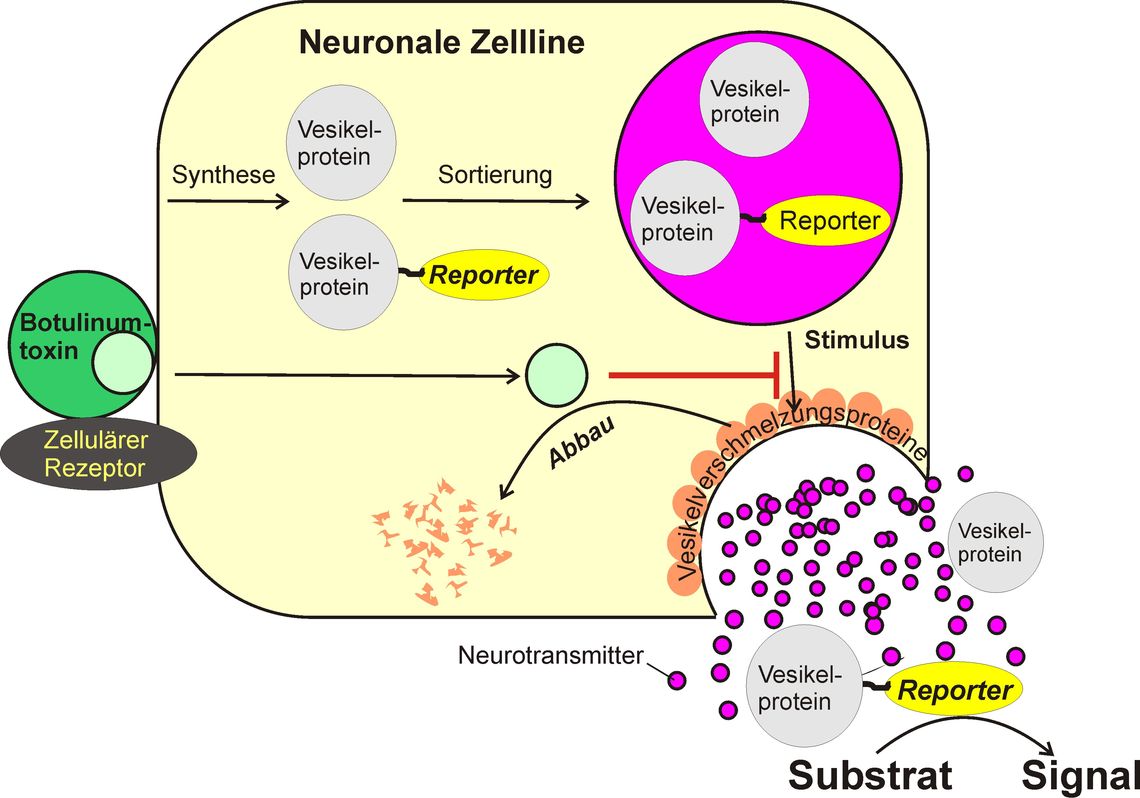
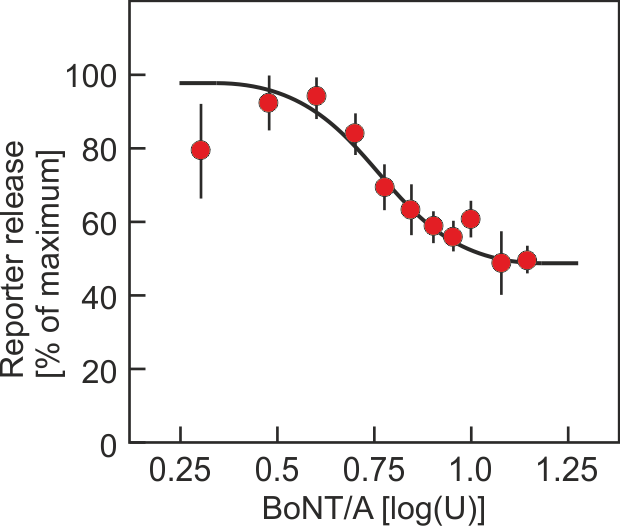
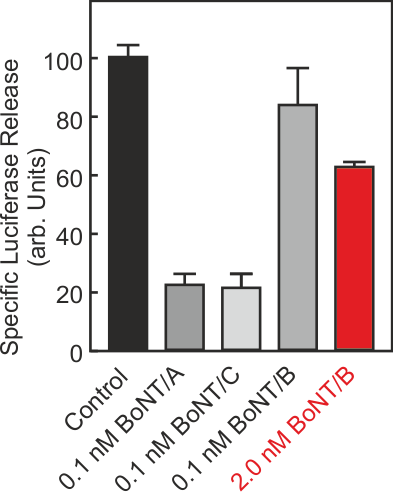
In dem Projekt wurde ein Zell-basiertes Verfahren zur Messung der Aktivität von Botulinumtoxin etabliert, das den Tierversuch weitgehend ersetzen kann. Es unterscheidet sich von allen bisher etablierten Ersatzverfahren dadurch, dass über einen Reporter, der gleichzeitig mit dem Neurotransmitter aus Nervenzellen freigesetzt wird, der Endpunkt der Botulinumtoxinwirkung, die Hemmung der Neurotransmitterfreisetzung aus der Nervenzelle, direkt erfasst wird. Dadurch wird sowohl die Aktivität der großen als auch die der kleinen Untereinheit in einem Schritt bestimmt und es sollte theoretisch möglich ein, die Aktivität des Toxins unabhängig vom Serotyp zu erfassen.
Das Prinzip (Abb. 1) beruht darauf, dass in der Zelle Proteine durch bestimmte Aminosäuresequenzen (Adresssequenzen) an eine bestimmte Adresse in der Zelle dirigiert werden können. So kann man mit geeigneten Adresssequenzen auch Proteine in die Speichervesikel lenken, aus denen die Überträgersubstanzen der Nervenzelle freigesetzt werden. Diese Proteine werden dann gemeinsam mit den Überträgersubstanzen freigesetzt bzw. ihre Freisetzung dann gehemmt, wenn die Freisetzung der Überträgersubstanzen gehemmt wird. Wählt man als Protein ein Enzym, das normalerweise nicht von den Zellen produziert wird, kann man die Freisetzung anhand der Aktivität des Enzyms im Zellkulturüberstand bestimmen, die Stimulus-abhängige Aktivität im Überstand nimmt ab, wenn durch Botulinumtoxin die Freisetzung der Überträgersubstanz gehemmt wird.

 Deutsch
Deutsch