Das Phänomen der Retinadegeneration betrifft zahlreiche Augenerkrankungen, wie das Glaukom oder die retinale Ischämie. Die Entstehungsprozesse dieser Erkrankungen sind bisher nicht vollständig verstanden, sodass Modelle benötigt werden, die dazu beitragen die pathologischen Veränderungen zu erfassen. Auch sind Modellsysteme zur Entwicklung neuer Therapieansätze und zur Testung neu entwickelter Therapiesubstanzen notwendig. Bisher basieren diese Studien meist auf akuten krankheitsinduzierten Tiermodellen, die eigens für die Versuche gezüchtet und getötet werden müssen. Organkulturen aus Explantaten der Schweineretina, die von Schlachttieren aus der Lebensmittelindustrie gewonnen werden können, bieten hier eine gute Alternative. Im Rahmen eines bereits von der Stiftung set geförderten Projektes konnten mehrere Degenerationsmodelle für das organotypische Kulturmodell der Schweineretina erfolgreich etabliert werden.
Im Rahmen dieses Projektes wurde untersucht, ob mit Hilfe des Kobaltchlorid- (CoCl2) und des Wasserstoffperoxid-Degenerationsmodells (H2O2) nicht nur die zugrundeliegenden Prozesse der Retinadegeneration analysiert werden können (Kuehn et al. 2017; Hurst et al. 2017), sondern ob sich diese Modelle auch für das Screening neuer Therapieansätze eignen. Daher wurde untersucht, ob durch eine Hypothermie sowie eine CoenzymQ10-Behandlung oder durch den iNOS-Hemmer 1400W eine Protektion retinaler Ganglienzellen und anderer Zelltypen erzielt werden kann. Gerade diese erfolgreiche Therapietestung ist für die Anerkennung als Tierersatzversuch von eminenter Bedeutung.
Für das Projekt wurde Schweineretinae verwendet, die vom lokalen Schlachthof bezogen wurden. Es wurden somit keine Tiere extra und ausschließlich für diese Versuche getötet, sondern Abfallprodukte der Lebensmittelindustrie eingesetzt. So wurden Versuchstiere komplett ersetzt werden, so dass es sich hier um den Ersatz eines Tierversuchs handelt (Replace).
Die Größe der Schweineaugen bietet des Weiteren den entscheidenden Vorteil, dass aus einem Schweineauge vier vergleichbare Proben entnommen und dadurch die Resultate verschiedener Methoden statistisch exakter korreliert werden können. Im Vergleich dazu reicht bei Mäusen und Ratten die Augengröße lediglich für je eine Probe aus. Daher konnte auch die Anzahl der benötigten Tiere reduziert werden (Reduce).
Im ersten Projektteil wurde der Einfluss von Hypothermie auf die allgemeinen Degenerationsprozesse der Retina untersucht. Die Hypothermie trug zum Schutz der retinalen Ganglienzellen vor der H2O2-induzierten Degeneration bei, indem die Apoptoserate gemindert wurde. Zusätzlich wurde nach acht Tagen, die durch H2O2 hervorgerufene mikrogliale Reaktion durch die Hypothermie vollständig neutralisiert. Bezüglich der makroglialen Reaktion wurden keine Auswirkungen von H2O2 oder der Hypothermie festgestellt. Im Gegensatz zu dem Verlust der cholinergen Amakrinzellen, der gemindert wurde, war der durch H2O2 bedingte Verlust der PKCα+ Bipolarzellen durch eine Hypothermie-Behandlung nicht aufzuhalten (Mueller-Buehl et al. 2020).
Die Hypothermiebehandlung im CoCl2-Degenerationsmodell führte zu einem Erhalt der Ganglien- und Bipolarzellen und hatte zudem eine positive Auswirkung auf apoptotische Vorgänge in den retinalen Zellen (Abb. 1). Auch der durch die CoCl2-Behandlung ausgelöste zelluläre Stress konnte mittels Hypothermie eingedämmt werden. Auf die CoCl2-induzierte Degeneration von Amakrin- und Horizontalzellen hatte die Hypothermie jedoch keinen Einfluss (Maliha et al. 2019).
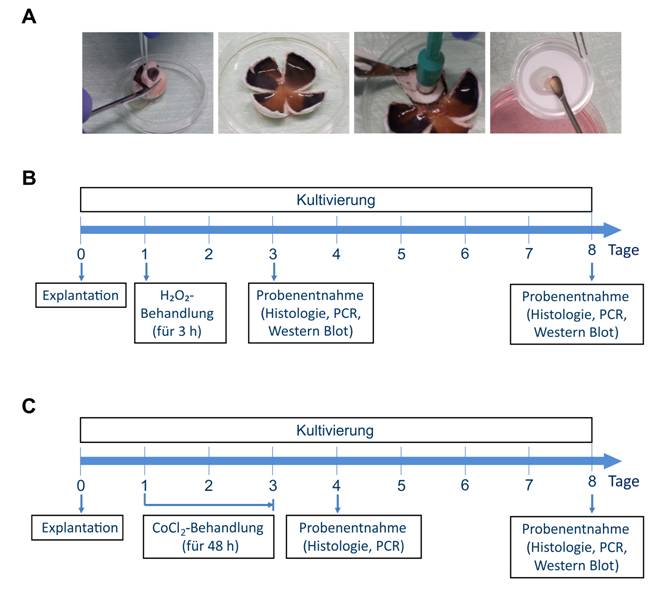
Abbildung 1: Schweineretinaorgankultur und zeitlicher Ablauf der drei Degenerationsmodelle:
A) Die Präparation der Schweineretinaorgankultur erfolgt über das Öffnen des Auges, die Herstellung einer Kleeblattstruktur, dem Ausstanzen der Retina und Überführen derselben auf einen Filter. Anschließend kann die Retina im Neurobasal-A-Medium kultiviert und mit toxischen und protektiven Substanzen behandelt werden. B) Ablauf des H2O2-Degenerationsmodells. Die Behandlung mit H2O2 erfolgte an Tag 1 für drei Stunden. Nach drei und acht Tagen wurden die Proben histologisch sowie mittels PCR- und Western-Blot-Analysen untersucht. C) Ablauf des CoCl2-Degenerationsmodells. Die Behandlung mit CoCl2 erfolgte an Tag 1 für 48 Stunden. Nach vier und acht Tagen wurden die Proben histologisch sowie mittels PCR- und Western-Blot-Analysen untersucht.
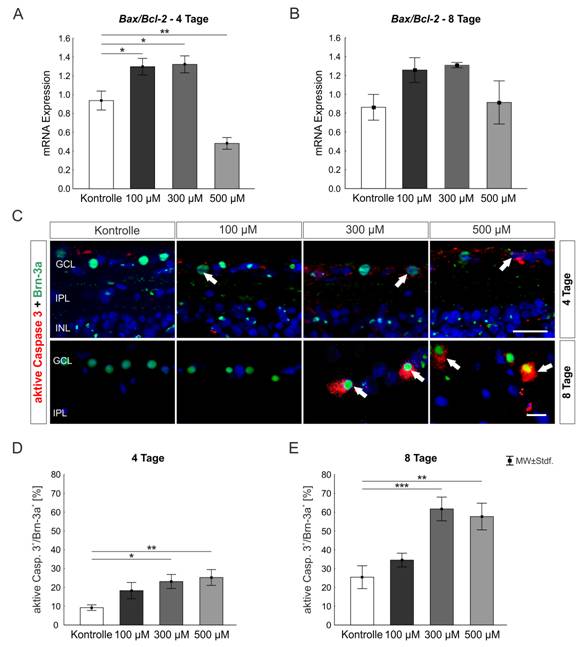
Abbildung 2: Aktivierung verschiedenster Zelltodmechanismen in der Kobaltchlorid-behandelten Schweineretinaorgankultur:
A) Das Bax/Bcl-2-Verhältnis wurde auf mRNA-Ebene nach vier Tagen untersucht. Nur die 100- und 300-µM-CoCl2-Gruppe wies eine Erhöhung von Bax/Bcl-2 auf (beide: p<0,05). In der 500-µM-Gruppe war das Verhältnis sogar herunterreguliert (p<0,01). B) Nach acht Tagen konnte kein Unterschied zwischen den Gruppen gemessen werden. C) Der Ganglienzellmarker Brn-3a (grün) wurde immunhistologisch in Kombination mit der aktiven Caspase 3 (rot) und einem Zellkernmarker (DAPI, blau) angefärbt. D) Nach vier Tagen waren mehr Ganglienzellen in der 300-µM- (p<0,05) und 500-µM-CoCl2-Gruppe (p<0,01) apoptotisch. E) Der Anteil an apoptotischen retinalen Ganglienzellen erhöhte sich noch in beiden Gruppen nach acht Tagen (300 µM: p<0,001; 500 µM: p<0,01). Maßstab=20 µM, Abkürzungen: GCL=Ganglienzellschicht, IPL=innere plexiforme Schicht (Kuehn et al. 2017).
Ausführende Institution
Forschungslabor, Universitäts-Augenklinik, Knappschaftskrankenhaus, Ruhr-Universität Bochum
In der Schornau 23-25, 44892 Bochum
Forschungslabor, Universitäts-Augenklinik Tübingen
Elfriede-Aulhorn-Str. 7, 72076 Tübingen
Förderlaufzeit
01/2017 - 06/2019

 Deutsch
Deutsch