Abb. 1:
Mikrofluidisches Chipsystem zur Zellkultivierung und Untersuchung der transepithelialen Migration von neutrophilen Granulozyten. Die integrierten Gold-Elektroden dienen der Impedanzmessung.
PD Dr. Christoph Beißwenger,
Universität des Saarlandes, Homburg/Saar
Prof. Dr. Heiko Zimmermann,
Fraunhofer-Institut für Biomedizinische Technik, Sulzbach
03/2018-08/2019
Entzündungszellen wie neutrophile Granulozyten tragen entscheidend zu Lungenschäden und zum Verlust an Lungenfunktion bei der Pneumonie, dem Acute Respiratory Distress Syndrome (ARDS) und der Mukoviszidose bei. Ziel dieses Projekts war die Kultivierung humaner Atemwegsepithelzellen und die Etablierung eines mikrofluidischen Chipsystems, in dem die transepitheliale Migration von neutrophilen Granulozyten aus dem Blutkreislauf in die Lunge abgebildet wird.
Der Gesamtaufbau des mikrofluidischen Chipsystems erfolgte im Objektträgerformat (Abb. 1).

Abb. 1:
Mikrofluidisches Chipsystem zur Zellkultivierung und Untersuchung der transepithelialen Migration von neutrophilen Granulozyten. Die integrierten Gold-Elektroden dienen der Impedanzmessung.
In das Fluidiksystem wurden humane Atemwegsepithelzellen eingebracht und kultiviert. Das Zellwachstums und die Zelldichte wurden über die Impedanz gemessen (Abb. 2A). Um zu testen, ob neutrophile Granulozyten über die epitheliale Barriere migrieren, wurden neutrophile Granulozyten in den unteren Kanal eingebracht. Zur Stimulation der Migration der Neutrophilen wurde in den Flüssigkeitsstrom im oberen Kanal des Chips das durch Hitze inaktivierte Pathogen Pseudomonas aeruginosa hinzugegeben. Es konnte eine Migration von Neutrophilen festgestellt werden (Abb. 2B).
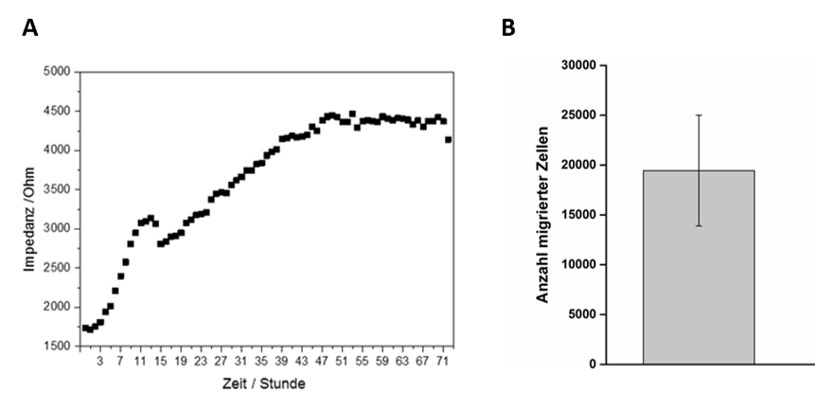
Abb. 2:
Untersuchung der Migration von Neutrophilen über Atemwegepithel. (A) Zeitlicher Verlauf der Impedanz, die während der Zellkultivierung in der Mikrokavität kontinuierlich gemessen wurde. (B) Anzahl migrierter Zellen über die epitheliale Barriere.
Zudem wurden im Rahmen dieses Projekts isolierte primäre Atemwegsepithelzellen über einen Zeitraum von 4 bis 5 Wochen zu Bronchosphären ausdifferenziert. Solche Bronchosphären können genutzt werden, um die Interaktion von Epithelzellen mit Entzündungszellen wie Neutrophile zu untersuchen. Die Bronchosphären wurden während der Differenzierungsphase mit bakteriellen Faktoren wie Flagellin von P. aeruginosa inkubiert, was zu einer übermäßigen Bildung von Mukus führte.
Das mikrofluidische In-vitro-Modell und die Lungenorganoide können genutzt werden, um die Interaktion von Entzündungszellen mit Atemwegsepithelzellen unter physiologisch relevanten Bedingungen zu analysieren. Die entwickelten Modelle stehen im Einklang mit dem 3R-Prinzip und tragen zur Reduktion von Tierversuchen im Bereich der Medikamentenentwicklung und Grundlagenforschung bei.
Publikation:
Sprott et al. (2020) Flagellin shifts 3D bronchospheres towards mucus hyperproduction. Respiratory Research 21:222; doi.org/10.1186/s12931-020-01486-x
Poster:
Hesler M., Knoll T., Ritzmann F., Honecker A., Wagner S., Kohl Y., von Briesen H., Zimmermann H., Bals R., Beisswenger C. „Microfluidic in vitro lung model to replace murine infection and ARDS models“ Posterpräsentation während der EUSAAT, 10.-13. Oktober 2019, Linz, Österreich.
Universität des Saarlandes - Innere Medizin V
Geb. 61.4, 66421 Homburg/Saar
Fraunhofer-Institut für Biomedizinische Technik IBMT
Joseph-von-Fraunhofer-Weg 1, 66280 Sulzbach
03/2018 - 08/2019